 Si tratta di esperimenti preliminari, ma la tecnica di editing genomico mostra notevoli potenzialità terapeutiche
Si tratta di esperimenti preliminari, ma la tecnica di editing genomico mostra notevoli potenzialità terapeutiche
Uno dopo l’altro, la terapia genica sta abbattendo tutti gli ostacoli sul suo cammino verso la ricerca di terapie sempre più efficaci contro il cancro e le malattie genetiche, imponendosi come una vera e propria rivoluzione nel mondo della medicina moderna. Ultimamente, molto del suo successo è dovuto alla messa a punto della tecnica CRISPR-Cas9, percepita come una straordinaria innovazione sia nei centri di cura che nei laboratori di ricerca.
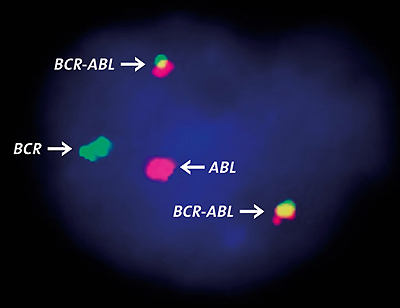
L’ultimo gol di questa tecnica è stato segnato proprio contro una delle forme più diffuse e pericolose di leucemia, la leucemia mieloide cronica (CML), una patologia mieloproliferativa che sul piano eziologico si contraddistingue per la presenza del cromosoma Philadelphia. Questa aberrazione genetica nasce dalla traslocazione di un frammento del cromosoma 9 sul cromosoma 22. In particolare, tale traslocazione bilanciata porta il gene ABL del cromosoma 9 ad inserirsi in punti diversi della regione BCR del cromosoma 22, generando la chimera genica BCR/ABL, che codifica per una tirosin-chinasi costitutivamente attiva. È proprio questa oncoproteina, denominata p210, ad avere un ruolo fondamentale nella patogenesi della CML, aumentando la capacità di sopravvivenza e proliferazione delle cellule mieloidi. Gli inibitori delle tirosin-chinasi, come imatinib e nilotinib, sono perciò divenuti la prima arma con cui fronteggiare la malattia, anche se l’evoluzione di meccanismi di resistenza ai farmaci hanno reso sempre più difficoltosa questa battaglia.
Tuttavia, i risultati di un recente studio, ideato e condotto da un gruppo di ricercatori spagnoli e pubblicato sulla rivista Oncotarget, puntano i riflettori sul possibile impiego della tecnica CRISPR-Cas9 come nuova arma contro la leucemia mieloide cronica. BCR/ABL sembra essere un bersaglio ideale per il complesso CRISPR-Cas9, che gli scienziati spagnoli hanno sperimentato per 'spegnere' la proteina p210 in un modello cellulare della CML.
Denominata Boff-p210, questa specifica linea di cellule, appositamente creata per esprimere il gene chimera BCR/ABL, mostra un'elevata capacità di sopravvivenza e moltiplicazione, anche in assenza della proteina interleuchina-3 (IL-3). Per poter inattivare BCR/ABL in queste cellule, i ricercatori hanno elaborato e testato tre diverse sequenze di RNA (sgRNA, single guided RNA), che avevano il compito di guidare l'azione di CRISPR-Cas9 verso il bersaglio voluto. Ricorrendo a metodiche di sequenziamento Sanger, in tutti e tre i casi è stata confermata la presenza di mutazioni nei siti attesi, a sostegno delle avvenute operazioni di modifica di BCR/ABL da parte di CRISPR-Cas9, e della specificità d’azione della tecnica.
Il passo successivo è stato lo studio in vitro degli effetti dell’inattivazione del gene chimera BCR/ABL in termini di progressione del ciclo cellulare e di apoptosi (morte cellulare). I dati hanno mostrato che, attraverso CRISPR-Cas9, è effettivamente possibile intervenire su BCR/ABL per indurre lo 'spegnimento' della proteina p210, inibendo la capacità delle cellule tumorali di crescere in assenza di IL-3 ed ottenendo un significativo aumento del loro tasso di apoptosi. Il risultato è stato particolarmente evidente in alcune delle cellule così trattate, denominate Bcr-Abl-SC, in cui l'azione di CRISPR-Cas9 aveva determinato uno specifico tipo di mutazione inattivante del gene BCR/ABL.
Infine, gli scienziati hanno inoculato queste cellule in vivo, in un modello murino, studiando la conseguente crescita della massa tumorale per un periodo di circa tre settimane: anche in questo caso, i topi transfettati con la linea cellulare modificata dal sistema CRISPR-Cas9 hanno sviluppato tumori di massa considerevolmente ridotta rispetto agli esemplari di controllo. Nei topi ai quali è stata iniettata la linea cellulare Bcr-Abl-SC non è stata addirittura osservata crescita tumorale.
La portata delle conclusioni di questo studio non si limita al campo della leucemia mieloide cronica, ma eleva l’asticella al di sopra della quale balza l’uso della metodica CRISPR-Cas9, che qui, per la prima volta, è stata usata per prevenire le potenzialità cancerogene di un processo di fusione genica. L’espressione di BCR/ABL conferisce alle cellule tumorali la capacità di sopravvivere e crescere anche in assenza di IL-3, mentre il sistema CRISPR-Cas9 sembra in grado di contrastare questa potenzialità, agendo, soprattutto, in maniera sicura e specifica. Infatti, L’azione di CRISPR-Cas9 si concretizza in un incremento dei livelli di apoptosi delle cellule tumorali e in una diminuzione del potenziale oncogenico di BCR/ABL, sia in vitro che in vivo.
Naturalmente, gli esiti di questo studio restano di carattere assolutamente preliminare e necessitano di ulteriori conferme. Tuttavia, le relative implicazioni sono di estrema importanza, dal momento che la filosofia attraverso la quale opera il sistema CRISPR-Cas9 potrebbe ben presto assestare un colpo mortale ai meccanismi di resistenza agli agenti farmacologici utilizzati per il trattamento della leucemia mieloide cronica, garantendo cure più sicure ed efficienti.