 Negli studi clinici, molti dei pazienti trattati hanno sperimentato una riduzione del 50% o più dei giorni di emicrania al mese
Negli studi clinici, molti dei pazienti trattati hanno sperimentato una riduzione del 50% o più dei giorni di emicrania al mese
Basilea (SVIZZERA) - La Commissione Europea (CE) ha recentemente approvato la prima e unica terapia specificamente progettata per la prevenzione dell'emicrania: il farmaco è stato sviluppato da Novartis, si chiama erenumab (Aimovig®) ed è indicato per gli adulti che manifestano almeno 4 giorni di emicrania al mese. Erenumab va assunto ogni 4 settimane e può essere somministrato, o auto-somministrato, mediante il dispositivo autoiniettore SureClick®.
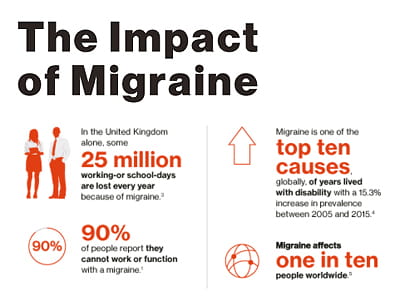
L'emicrania è una definita malattia neurologica contraddistinta da attacchi ricorrenti di mal di testa, con un dolore da moderato a severo, tipicamente pulsante, spesso unilaterale e associato a nausea, vomito e sensibilità alla luce, al suono e agli odori. La patologia ha un profondo impatto negativo sulla capacità di un individuo di svolgere le proprie normali attività quotidiane, ed è stata indicata dall'Organizzazione Mondiale della Sanità come una delle prime 10 cause di disabilità pluriennale, sia per gli uomini che per le donne. L'emicrania è tuttora un disturbo sotto-riconosciuto e sotto-trattato. Le terapie preventive esistenti si basano sull'impiego di medicinali indicati per altre patologie e sono spesso associate a scarsa tollerabilità e mancanza di efficacia, con elevati tassi di interruzione del trattamento da parte dei pazienti.
"L'emicrania è importante: è una malattia neurologica dolorosa e altamente lesiva, che pregiudica tutti gli aspetti della vita, dal lavorare al trascorrere del tempo libero con la famiglia e gli amici", ha dichiarato Patrick Little, Presidente della European Migraine and Headache Alliance. "Un trattamento specificamente ideato per la prevenzione dell'emicrania è un'innovazione molto gradita e potrebbe cambiare la vita dei pazienti per i quali le attuali terapie non funzionano o non sono ben tollerate".
Erenumab è un farmaco progettato per bloccare il recettore del peptide correlato al gene della calcitonina (CGRP-R), una molecola che svolge un ruolo fondamentale nello sviluppo del dolore correlato all'emicrania. Erenumab è stato valutato in un programma di sperimentazione clinica che ha coinvolto, complessivamente, più di 3.000 pazienti. Nei 4 principali studi clinici, controllati con placebo, i soggetti trattati con erenumab hanno ottenuto una significativa riduzione del numero di giorni di emicrania al mese, e il farmaco ha evidenziato un profilo di sicurezza e tollerabilità simile al placebo.
Erenumab si è dimostrato efficace anche in una popolazione di pazienti particolarmente difficile da trattare, rappresentando l'unica terapia mirata al CGRP-R ad essere stata specificamente valutata in individui in cui erano già precedentemente falliti da 2 a 4 trattamenti comunemente usati per la prevenzione dell'emicrania.
Inoltre, l'analisi ad interim dei dati relativi ad uno studio di estensione quinquennale, in aperto, tuttora in corso in persone con emicrania episodica, ha dimostrato che, al 15° mese di sperimentazione, il 26% dei soggetti trattati con erenumab 70 mg era completamente privo di emicrania.
Gli eventi avversi più comuni fino ad ora riscontrati nel programma di sviluppo clinico di erenumab sono infezioni del tratto respiratorio superiore (virali e non), sinusite, influenza e mal di schiena.
"L'approvazione di oggi è un evento rivoluzionario per le persone che vivono con emicrania, per le loro famiglie e i loro medici", ha dichiarato Paul Hudson, Amministratore Delegato di Novartis Pharmaceuticals. "Negli studi clinici, erenumab ha dimostrato di essere efficace nel prevenire l'emicrania e di fornire sollievo dalla morsa di questa malattia. Siamo orgogliosi di essere i primi ad aver reimmaginato la prevenzione dell'emicrania e ci impegniamo a rendere disponibile erenumab per tutti coloro che potrebbero trarne beneficio. Stiamo lanciando un programma personalizzato di accesso post-approvazione e stiamo esplorando una serie di innovativi approcci di rimborso, incluso un pagamento limitato a quei pazienti che rispondono bene al trattamento".
Clicca qui per scaricare l'infografica completa sull'impatto dell'emicrania (2018).
Per ulteriori informazioni è possibile consultare il comunicato stampa aziendale.



















































Seguici sui Social